
Ο καρκίνος των ωοθηκών αποτελεί την πλέον επικίνδυνη γυναικολογική νεοπλασία. Οι προσπάθειες για έγκαιρη διάγνωση καθώς και νέα θεραπευτικά σχήματα ήταν ανεπιτυχείς εξαιτίας του ότι η προέλευση και η παθογένεση των επιθηλιακών όγκων της ωοθήκης είναι άγνωστη. Μολονότι πραγματοποιήθηκαν πολλές μελέτες για την ανάδειξη προκαρκινικών αλλοιώσεων στις ωοθήκες , καμία από αυτές δεν έδωσε τα επιθυμητά αποτελέσματα. Για αυτόν τον λόγο υποστηρίζεται ότι ο καρκίνος των ωοθηκών αναπτύσσεται de novo. Μελέτες απέδειξαν ότι ο επιθηλιακός όγκος των ωοθηκών δεν αποτελεί μοναδική οντότητα, αλλά αποτελεί ένα σύνολο διαφορετικών τύπων καρκίνων, οι οποίοι μπορούν να ταξινομηθούν βάσει μορφολογικών και μοριακών γενετικών χαρακτηριστικών. Η πρώτη ομάδα καρκίνων, Τύπος I, αποτελείται από τα χαμηλού βαθμού ορώδη, ενδομητριοειδή, διαυγοκυτταρικά, βλεννώδη και μεταπλαστικά (Brenner) καρκινώματα. Αυτοί οι καρκίνοι γενικά δεν παρουσιάζονται με άλγος, συνορεύουν με τις ωοθήκες και γενικώς είναι γενετικά σταθεροί. Δεν παρουσιάζουν μετάλλαξη στο γονίδιο TP53 αλλά κάθε ιστολογικός τύπος παρουσιάζεται με ένα διαφορετικό μοριακό γενετικό προφίλ. Επιπλέον, αυτός ο τύπος καρκίνου παρουσιάζει κοινή γενεαλογία με το αντίστοιχο καλοήθες κυστικό νεόπλασμα συνήθως μέσα από ένα ενδιάμεσο στάδιο (όγκος χαμηλής δυνητικής κακοήθειας-borderline tumor), γεγονός που υποστηρίζει την μορφολογική συνέχεια της πορείας του καρκίνου.
Αντιθέτως, μια άλλη ομάδα καρκίνων, Τύπος II, είναι εξαιρετικά επιθετικοί, αφού αναπτύσσονται γρήγορα και σχεδόν πάντα την στιγμή της διάγνωσης είναι σε προχωρημένο στάδιο. Αυτή η ομάδα περιλαμβάνει υψηλού βαθμού ορώδη καρκινώματα, αδιαφοροποίητα καρκινώματα και καρκινοσαρκώματα. Εμφανίζουν μετάλλαξη στο γονίδιο ΤP53 σε πάνω από το 80% των περιπτώσεων, ενώ σπάνια παρουσιάζουν τις μεταλλάξεις που ανευρίσκονται στους καρκίνους Τύπου I. Πιο αναλυτικά οι διαφορές των δύο τύπων φαίνονται στον παρακάτω πίνακα 1:
Πίνακας 1: Διαφορές Τύπου Ι και ΙΙ όγκων των ωοθηκών
| ΤΥΠΟΥ Ι | ΤΥΠΟΥ ΙΙ | |
| Επιθετικότητα | Μικρή | Μεγάλη |
| Ανάπτυξη | Σταδιακή | Γρήγορη |
| Προχωρημένο στάδιο στη διάγνωση | Μέσω Borderline | Ναι |
| TP53 μετάλλαξη | Όχι | Ναι |
Πρόσφατες έρευνες παρείχαν ισχυρά αποδεικτικά στοιχεία πως αυτό που μέχρι πρότινος θεωρούνταν πρωτογενής καρκίνος ωοθηκών τελικά ξεκινά από άλλα όργανα της πυέλου. Προτείνεται ότι οι ορώδεις όγκοι ξεκινούν από την εμφύτευση επιθηλίου (καλοήθους ή κακοήθους) από τις σάλπιγγες. Οι ενδομητριοειδείς και διαυγοκυτταρικοί όγκοι συνδυάστηκαν με την ενδομητρίωση, λόγω παλίνδρομης εμμηνορρυσίας. Τέλος, έρευνες σε εξέλιξη δείχνουν πως ο βλεννώδης και ο μεταπλαστικός όγκος (Brenner) των ωοθηκών προκύπτουν από μεταπλαστικού τύπου επιθήλιο που αναπτύσσεται στο σαλπιγγο-μεσοθηλιακό σύνδεσμο μετά από μια διαδικασία μεταπλασίας.
Ταξινόμηση
Τα ιστολογικά χαρακτηριστικά και ο βαθμός κακοήθειας των νεοπλασμάτων της ωοθήκης παρουσιάζουν μεγάλη ποικιλία, η οποία εκφράζεται και με τις ιδιαιτερότητες που έχει η κλινική συμπεριφορά τους. Η περισσότερο πρακτική και σε χρήση ταξινόμησή τους είναι αυτή που στηρίζεται στην ιστογενετική τους προέλευση και διακρίνονται στον πίνακα 2:
Πίνακας 2: Ταξινόμηση
- Όγκους από το βλαστικό επιθήλιο
- Όγκους από τα γεννητικά κύτταρα
- Όγκους από το εξειδικευμένο (λειτουργικό) μεσέγχυμα
- Όγκους από το μη λειτουργικό μεσέγχυμα
- Μεταστατικούς όγκους
Στην ωοθήκη υπάρχουν 4 βασικά είδη ιστών με διαφορές στην προέλευση και τη λειτουργικότητα.
- Το βλαστικό επιθήλιο που την περιβάλλει: Προέρχεται απο το επιθήλιο της σπλαχνικής κοιλότητας του εμβρύου (μεσόδερμα) και μπορεί να θεωρηθεί ως τροποποιημένο μεσοθήλιο. Έχει κοινή προέλευση με το επιθήλιο του περιτοναίου και τα κύτταρα του μπορούν να υποστούν μεταπλασία. Από το βλαστικό επιθήλιο προέρχονται οι επιθηλιακοί όγκοι οι οποίοι διακρίνονται στον πίνακα 3:
Πίνακας 3: Ιστολογική ταξινόμηση επιθηλιακών όγκων
- Ορώδεις
- Βλεννώδεις
- Ενδομητριοειδείς
- Μεσονεφρικοί (διαυγοκυτταρικοί)
- Όγκοι Brenner
- Αδιαφοροποίητα καρκινώματα
- Καρκινοσαρκώματα και μικτοί μεσοδερματικοί όγκοι
- Τα γεννητικά κύτταρα: Αυτά πρωτοεμφανίζονται στο λεκιθικό ασκό του εμβρύου (αρχέγονα γεννητικά κύτταρα) και από εκεί μεταναστεύουν κατά μήκος της ρίζας του μεσεντερίου για να συναντήσουν τον αρχέγονο γεννητικό αδένα. Αυτός πρωτοσχηματίζεται κατά την έκτη εβδομάδα της εμβρυϊκής ζωής ως πάχυνση του επιθηλίου (γεννητική ταινία) στη σπλαγχνική κοιλότητα. Τα γεννητικά κύτταρα εισδύουν στο επιθήλιο και εγκαθίστανται στο υποκείμενο μεσέγχυμα. Από τα κύτταρα αυτά προέρχονται οι όγκοι των γεννητικών κυττάρων.
- Το εξειδικευμένο μεσέγχυμα: Αποτελείται από τα κύτταρα που παράγουν τις ορμόνες του θήλεος (τα κοκκώδη και τα κύτταρα της θήκης του ωοθυλακίου) και τα υπολείμματα των κυττάρων του αρχέγονου γεννητικού αδένα που προορίζονται για την παραγωγή ανδρογόνων και σπερματοζωαρίων (κύτταρα Leydig και Sertoli). Ανάλογα με την προέλευση και τη σύστασή τους οι όγκοι από τα παραπάνω κύτταρα, παρουσιάζουν την ανάλογη ορμονοπαραγωγή και κλινική συμπεριφορά.
- Μη ειδικό μεσέγχυμα: Είναι ο στηρικτικός ιστός της ωοθήκης (συνδετικός ιστός, αγγεία, λίπος από τον οποίο μπορούν να προέλθουν καλοήθεις αλλά και κακοήθεις όγκοι (σαρκώματα).
Οι επιθηλιακοί καρκίνοι των ωοθηκών αποτελούν τη συντριπτική πλειοψηφία των κακοήθων όγκων της ωοθήκης και είναι πραγματικά ταυτόσημοι με την έννοια του ωοθηκικού καρκίνου. Τα κυτταρικά χαρακτηριστικά τους προσομοιάζουν με το επιθήλιο ενός από τα γεννητικά όργανα. Οι ορώδεις όγκοι είναι οι συχνότεροι (75-80%) και η ιστολογική τους εικόνα είναι παρόμοια με το επιθήλιο της σάλπιγγας. Οι ενδομητριοειδείς και οι βλεννώδεις είναι λιγότερο συχνοί (περίπου 10%) και προσομοιάζουν στο επιθήλιο του ενδομητρίου και του ενδοτραχήλου αντίστοιχα. Σπανιότεροι επιθηλιακοί καρκίνοι των ωοθηκών είναι τα αδιαφοροποίητα, τα διαυγοκυτταρικά καρκινώματα, οι όγκοι του Brenner και οι μικτοί τύποι νεοπλασμάτων.
Επιδημιολογία – Αιτιολογία
Η μεγαλύτερη συχνότητα καρκίνου των ωοθηκών παρατηρείται σε γυναίκες ηλικίας 55-65 ετών. Στην πραγματικότητα, η συχνότητα της νόσου αυξάνεται διαρκώς σε όλη τη διάρκεια της ζωής, μέχρι την ηλικία των 80 ετών. Ιδιαίτερα συχνή είναι στη Β.Αμερική (ΗΠΑ). Χαμηλή επίπτωση παρατηρείται σε χώρες της Νοτιοανατολικής Ασίας (Ιαπωνία). Είναι χαρακτηριστική η διαπίστωση, ότι τα παιδιά των Ιαπωνίδων που έχουν μεταναστεύσει στις ΗΠΑ παρουσιάζουν αύξηση του κινδύνου για να αναπτύξουν επιθηλιακούς καρκίνους ωοθήκης. Θεωρείται ότι οι αιτιολογικοί παράγοντες της νόσου σχετίζονται με το περιβάλλον και τον τρόπο ζωής στις δυτικές βιομηχανικές χώρες.
Ο καρκίνος της ωοθήκης προσβάλλει συνήθως γυναίκες μεγαλύτερες των 40 ετών (80-90%). Η πιθανότητα παρουσίας κακοήθειας (Borderline ή διηθητικής νόσου) σε ένα νεόπλασμα ωοθήκης το οποίο αναπτύσσεται σε γυναίκες νεότερες των 40, είναι περίπου 1/10. Ο κίνδυνος αυξάνει σημαντικά μετά την ηλικία αυτή και μετά την εμμηνόπαυση γίνεται 1/3. Λιγότερες από 1 στις 100 περιπτώσεις αφορούν σε γυναίκες μικρότερες των 20 ετών. Στις νεαρές αυτές ηλικίες οι όγκοι της ωοθήκης προέρχονται κατά τα 2/3 από τα γεννητικά κύτταρα (πίνακας 4):
Πίνακας 4:
Ηλικιακές ομάδες
Είδος όγκων <20 ετών 20-50ετών >50 ετών
Επιθηλιακοί 29% 71% 81%
Από γεννητικά κύτταρα 59% 14% 6%
Από λειτουργικό μεσέγχυμα 8% 5% 4%
Από μη λειτουργικό μεσέγχυμα 4% 10% 9%
Μηχανισμοί καρκινογένεσης – Παράγοντες κινδύνου
α) Η θεωρία της ωοθυλακιορρηξίας
Διατυπώθηκε από τον Fathalla το 1972. Κατ’ αυτήν, ο τραυματισμός του επιθηλίου που συνεπάγεται η ΩΘΡ και οι διαδικασίες επούλωσης που ακολουθούν, ευνοούν τη δημιουργία των προϋποθέσεων για την δράση των μηχανισμών καρκινογένεσης και την ανάπτυξη μεταλλάξεων. Η ΩΘΡ σχετίζεται επίσης με το σχηματισμό κυτταρικών εγκλείστων τα οποία με τη μορφή μικρών κύστεων ανευρίσκονται υποεπιθηλιακά, στο στρώμα της ωοθήκης. Το επιθήλιο των κύστεων αυτών μπορεί να υποστεί μεταπλασία και ακολούθως να παρουσιάσει δυσπλασία και καρκίνο. Θεωρείται ότι οι παράγοντες που ελαττώνουν ή αυξάνουν τον αριθμό των ΩΘΡ στη διάρκεια της ζωής της γυναίκας (π.χ κυήσεις και αντισυλληπτικό δισκίο (ΑΔ) ή καθυστερημένη εμμηνόπαυση αντίστοιχα), επιδρούν αρνητικά ή θετικά στον κίνδυνο ανάπτυξής επιθηλιακών καρκίνων ωοθήκης.
β) Θεωρία των γοναδοτροφινών
Μελέτες σε πειραματόζωα και επιδημιολογικές παρατηρήσεις υποστηρίζουν την άποψη ότι η μεγάλη αύξηση των γοναδοτροφινών στην κυκλοφορία, ευνοεί τη δημιουργία μεταλλάξεων στο επιθήλιο της ωοθήκης. Οι υποστηρικτές της θεωρίας αυτής αποδίδουν την προστατευτική επίδραση των ΑΔ στην ελάττωση παραγωγής γοναδοτροφινών, την οποία προκαλεί η χορήγησή τους.
γ) Θεωρία των στεροειδών ορμονών
Η παρουσία υποδοχέων των ανδρογόνων, οιστρογόνων και προγεστερόνης στο επιθήλιο της ωοθήκης και μια ποικιλία επιδημιολογικών παρατηρήσεων, δεδομένων, οδήγησε ορισμένους ερευνητές στην υπόθεση ότι η δράση των στεροειδών αυτών μπορεί να αυξάνει (ανδρογόνα) ή να ελαττώνει (προγεστερόνη) τον κίνδυνο ανάπτυξης επιθηλιακών καρκίνων ωοθήκης. Γυναίκες που έλαβαν αντισύλληψη με προγεστερόνη μόνο, παρουσίασαν σχετικό κίνδυνο (RR) για ανάπτυξη ΕΚΩ 0,39, για χρήση μέχρι 3 χρόνια και 0,21 για χρήση σε μεγαλύτερο διάστημα. Επειδή τα αντισυλληπτικά αυτά δεν αναστέλλουν την ΩΘΡ στο 40% περίπου των γυναικών, η προστατευτική τους επίδραση αποδίδεται στη δράση της προγεστερόνης και όχι στην αναστολή της ΩΘΡ.
Άσχετα από το βαθμό αξιοπιστίας της κάθε μιας από τις παραπάνω θεωρίες, οι σύγχρονες απόψεις για το ρόλο των σημαντικότερων παραγόντων που τροποποιούν το RR για ανάπτυξη επιθηλιακών καρκίνων ωοθήκης (ΕΚΩ), μπορούν να συνοψιστούν στα ακόλουθα:
- Τεκνοποίηση: Η προστατευτική δράση της έχει επιβεβαιωθεί σε αρκετές μελέτες. Γυναίκες με παιδιά έχουν 45% ελαττωμένο κίνδυνο για τη νόσο, σε σύγκριση με άτεκνες. Κάθε τοκετός υπολογίζεται ότι προσφέρει προστασία κατά 13-19%.
- Αντισυλληπτικό δισκίο: η χορήγησή του δρα προστατευτικά, ελαττώνοντας το σχετικό κίνδυνο κατά 30-60%. Η διάρκεια λήψης του σχετίζεται επίσης με το βαθμό προστασίας. Η μείωση του κινδύνου υπολογίζεται σε 11% για λήψη επί ένα έτος και φτάνει στο 50% για λήψη 5 ή περισσότερων ετών.
- Ηλικία εμμηναρχής και εμμηνόπαυσης: Παρ’ όλο που έχει αναφερθεί κάποια μικρή προστατευτική επίδραση σε γυναίκες με καθυστερημένη εμμηναρχή, τα δεδομένα που υπάρχουν δεν θεωρούνται ικανά για να τη βεβαιώσουν. Η καθυστερημένη εμμηνόπαυση διαπιστώθηκε ότι σχετίζεται με μικρή αύξηση του κινδύνου σε ορισμένες Ευρωπαϊκές μελέτες.
- Η υστερεκτομή με διατήρηση των ωοθηκών σχετίζεται με ελάττωση του κινδύνου κατά 33-36%. Σημαντική επίσης προστασία προσφέρει η απολίνωση των σαλπίγγων. Στην Nurse’s Health Study η συχνότητα καρκίνου ωοθήκης βρέθηκε μειωμένη κατά 67% στις γυναίκες με απολίνωση των σαλπίγγων.
Αναλυτικά οι παράγοντες που επιδρούν στον κίνδυνο ανάπτυξης καρκίνου ωοθήκης μπορεί να προκαλέσουν, φαίνονται στον πίνακα 5:
Πίνακας 5: Παράγοντες κινδύνου Ca ωοθήκης
Ι) Αύξηση κινδύνου ΙΙ) Ελάττωση κινδύνου
Κληρονομικότητα Αντισυλληπτικό δισκίο
Καθυστερημένη εμμηνόπαυση Τεκνοποίηση
Ορμονοθεραπεία υποκατάστασης Υστερεκτομή
Στειρότητα Απολίνωση σαλπίγγων
Θηλασμός
Ακεταμινοφαίνη
Φενρετινίδη
Μολονότι πραγματοποιήθηκαν πολλές μελέτες που σκοπό είχαν την ανάδειξη προκαρκινικών αλλοιώσεων, καμία δεν απέδωσε. Αυτό οδήγησε στην πρόταση πως ο καρκίνος της ωοθήκης αναπτύσσεται de novo.
Κάθε χρόνο στις Ηνωμένες Πολιτείες 21550 γυναίκες αναπτύσσουν καρκίνο ωοθηκών “de novo” και 14600 θα πεθάνουν από τη νόσο. Ο καρκίνος των ωοθηκών είναι ο πλέον θανατηφόρος από όλους τους γυναικολογικούς καρκίνους. Είναι ξεκάθαρο πως ο όρος de novo αντανακλά την άγνοια μας σχετικά με τα πρώιμα γεγονότα της καρκινογένεσης των ωοθηκών. Υπάρχουν 3 θεωρίες:
- Παρόλο που είναι γενικά αποδεκτό πως υπάρχουν μεγάλες διαφορές μεταξύ των διαφόρων ιστολογικών τύπων, η μεγάλη πλειοψηφία των ωοθηκικών όγκων είναι υψηλού βαθμού ορώδεις όγκοι και για το λόγο αυτό ο καρκίνος των ωοθηκών θεωρείται ως ξεχωριστή πάθηση.
- Ο ωοθηκικός καρκίνος προέρχεται από το επιφανειακό ωοθηκικό επιθήλιο (μεσοθήλιο), το οποίο εγκολεάζει προς το υποκείμενο στρώμα δημιουργώντας κύστες οι οποίες υφίστανται κακοήθη μεταμόρφωση.
- Ο ωοθηκικός καρκίνος εκτείνεται από την ωοθήκη έως την πύελο, την κοιλιά και σε πιο απομακρυσμένες περιοχές.
Βασιζόμενοι σε αυτές τις θεωρίες καρκινογένεσης, οι προσπάθειες έχουν επικεντρωθεί στην έγκαιρη ανίχνευση του καρκίνου των ωοθηκών όταν είναι ακόμα περιορισμένος στην ωοθήκη, καθώς και στην ανάπτυξη νέων χημειοθεραπευτικών σχημάτων. Δυστυχώς αυτές οι προσπάθειες δεν έχουν αποδώσει δεδομένου ότι η επιβίωση των γυναικών με καρκίνο των ωοθηκών δεν έχει αλλάξει τα τελευταία 50 χρόνια. Αυτό εξηγείται με βάση το γεγονός ότι οι θεωρίες της ιστογένεσης πάνω στις οποίες βασίζονται αυτές οι προσπάθειες είναι ελλιπείς.
Μορφολογική και μοριακή ανομοιογένεια των επιθηλιακών όγκων ωοθήκης
Ένα από τα μεγαλύτερα προβλήματα για την κατανόηση αυτών των όγκων είναι ότι πρόκειται για μια πάθηση η οποία παρουσιάζεται με ένα σύνολο διαφορετικών καρκίνων με μεγάλες διαφορές στην κλινικοπαθολογική εικόνα και συμπεριφορά. Βασιζόμενοι σε μια σειρά μορφολογικών και μοριακών γενετικών μελετών, προτάθηκε ένα δυαδικό μοντέλο που κατηγοριοποιεί τους διάφορους τύπους ωοθηκικού καρκίνου σε δυο ομάδες: Τύπου I και Τύπου II.
Η ομάδα Τύπου I έχει ανώδυνη κλινική εικόνα και συνήθως παρουσιάζεται σε χαμηλό στάδιο. Παρουσιάζει κοινή γενεαλογία με το αντίστοιχο καλοήθες κυστικό νεόπλασμα συνήθως μέσα από ένα ενδιάμεσο στάδιο χαμηλής δυνητικής κακοήθειας (borderline tumor) που υποστηρίζει τη μορφολογική συνέχεια της πορείας της νόσου. Αυτή η αλληλουχία γεγονότων παρουσιάζει ομοιότητες με εκείνη μεταξύ αδενώματος και καρκίνου παχέως εντέρου. Η ομάδα Τύπου I, αποτελείται από χαμηλού βαθμού ορώδεις, ενδομητριοειδείς, διαυγοκυτταρικούς, βλεννώδεις και μεταπλαστικούς (Brenner) τύπους καρκίνων.
Αντίθετα από τις ξεκάθαρες μορφολογικές διαφορές των καρκίνων της ομάδας Τύπου I, οι μορφολογικές διαφορές στην ομάδα Τύπου II είναι λιγότερο εμφανείς και ως αποτέλεσμα υπάρχει πρόβλημα στη διάγνωση από τους παθολογοανατόμους.
Η ομάδα Τύπου II εκφράζεται με θηλοειδή, αδενοειδή και συμπαγή στοιχεία και διαγιγνώσκεται ως υψηλού βαθμού ορώδες, ενδομητροειδές ή αδιαφοροποίητο καρκίνωμα ανάλογα με το κυρίαρχο στοιχείο. Γενικά οι περισσότεροι παθολογοανατόμοι τους κατηγοριοποιούν ως υψηλού βαθμού ορώδεις νεοπλασίες ακόμα κι αν παρουσιάζουν ελάχιστη ομοιότητα με το σαλπιγγικού τύπου επιθήλιο (η βάση για να ορίσεις ένα καρκίνο ως ορώδη).
Τα καρκινοσαρκώματα (malignant mixed mesodermal tumors), ανήκουν στην ομάδα Τύπου ΙΙ επειδή παρουσιάζουν επιθηλιακά στοιχεία όμοια με τους όγκους της ομάδας Τύπου II. Οι καρκίνοι Τύπου II είναι εξαιρετικά επιθετικοί και σχεδόν πάντα διαγιγνώσκονται σε προχωρημένα στάδια. Αποτελούν περίπου το 75% όλων των επιθηλιακών όγκων της ωοθήκης και έχουν σχετικά όμοια μορφολογικά στοιχεία πτωχή πρόγνωση. Οι μορφολογικές διαφορές μεταξύ Τύπου I και Τύπου II καθρεφτίζονται μέσα από διαφορές στο μοριακό γενετικό επίπεδο.
Ως ομάδα οι καρκίνοι Τύπου I είναι γενετικά πιο σταθεροί από τους Τύπου II και παρουσιάζουν μεταλλάξεις. Έτσι, οι μεταλλάξεις KRAS, BRAF και ERB2 εμφανίζονται στα 2/3 των χαμηλόβαθμων όγκων ορώδους τύπου, ενώ οι μεταλλάξεις TP53 είναι σπάνιες σε αυτές τις νεοπλασίες. Ο χαμηλόβαθμος ενδομητριοειδής τύπος παρουσιάζει παρεκκλίσεις στην οδό wnt που αφορά σωματικές μεταλλάξεις των CTNNB1, PTEN και PIK3CA γονιδίων. Ο βλεννώδης τύπος παρουσιάζει μεταλλάξεις KRAS σε περισσότερο απο το 50% των δειγμάτων. Ο διαυγοκυτταρικός τύπος έχει υψηλά ποσοστά μεταλλάξεων του RIK3CA. Υπάρχουν λίγα στοιχεία όσων αφορά τους καρκίνους Brenner. Ο υψηλόβαθμος ορώδης τύπος χαρακτηρίζεται από πολύ συχνές μεταλλάξεις στο TP53 (>80% των περιπτώσεων) και στο CCNE1.
Ανακεφαλαιώνοντας οι νεοπλασίες Τύπου I ως ομάδα είναι γενετικά πιο σταθεροί από τους Τύπου II και παρουσιάζουν ένα διαφορετικό χαρακτήρα μεταλλάξεων που εμφανίζονται σε ειδικούς τύπους κυττάρων (χαμηλόβαθμα ορώδη, ενδομητριοειδή, διαυγοκυτταρικά και βλεννώδη). Αντιθέτως, οι νεοπλασίες Τύπου II (υψηλόβαθμοι ορώδεις, ενδομητριοειδείς, αδιαφοροποίητοι καρκίνοι) δείχνουν μια μεγαλύτερη μορφολογική και μοριακή ομοιογένεια, είναι γενετικώς ασταθείς και έχουν πολύ υψηλά ποσοστά μεταλλάξεων TP53. Αυτά τα ευρήματα υποδηλώνουν ότι οι διαφορετικοί τύποι καρκίνων των ωοθηκών αναπτύσσονται διαμέσου διαφορετικών μοριακών οδών.
Τα κύτταρα προέλευσης των περισσότερων επιθηλιακών όγκων ωοθήκης δεν είναι ωοθηκικά
Τα κύτταρα από τα οποία προέρχεται ο καρκίνος των ωοθηκών και οι μηχανισμοί μέσω των οποίων ο καρκίνος αναπτύσσεται ακόμα ερευνώνται. Η ευρύτερα αποδεκτή άποψη για την ωοθηκική καρκινογένεση υποστηρίζει ότι οι διάφοροι τύποι καρκίνου της ωοθήκης προέρχονται όλοι από το επιφανειακό επιθήλιο της ωοθήκης (μεσοθήλιο) και οι επικείμενες μεταπλαστικές αλλαγές οδηγούν στην ανάπτυξη των διαφορετικών κυτταρικών τύπων (ορώδες, ενδομητριοειδές, διαυγοκυτταρικό, βλεννώδες, Brenner) οι οποίοι μορφολογικά μοιάζουν με το επιθήλιο των σαλπίγγων, του ενδομητρίου, του γαστρεντερικού σωλήνα ή του ενδοτραχήλου και της ουροδόχου κύστης, αντίστοιχα. Η φυσιολογική ωοθήκη, παρ’ όλα αυτά, δεν έχει κανένα στοιχείο που να μοιάζει με αυτούς τους καρκίνους. Επιπλέον, εμβρυολογικά ο τράχηλος, το ενδομήτριο και οι σάλπιγγες προέρχονται από τους πόρους του Muller, ενώ η ωοθήκη αναπτύσσεται από το διάμεσο μεσόδερμα στην ουρογεννητική ακρολοφία διαχωριζόμενη από τους πόρους του Muller. Συνεπώς, μια εναλλακτική θεωρία προτείνει ότι οι καρκίνοι με Mυλλεριανό φαινότυπο (ορώδης, ενδομητριοειδής και διαυγοκυτταρικός) δεν προέρχονται από το μεσοθήλιο αλλά από Mυλλεριανούς ιστούς. Αυτού του είδους οι ιστοί ανευρίσκονται παρασαλπιγγικά ή παραωοθηκικά και χαρακτηρίζονται ως δευτερογενές Μυλλεριανό σύστημα.
Σύμφωνα με αυτή τη θεωρία, οι όγκοι ωοθήκης προέρχονται από αυτά τα έγκλειστα. Καθώς ο όγκος μεγαλώνει, συμπιέζει και πιθανόν εξαλείφει τον ωοθηκικό ιστό με αποτέλεσμα να φαίνεται ως εξαρτηματικός όγκος που προέρχεται από την ωοθήκη. Πρόσφατα, προέκυψε μια άλλη θεωρία που υποστηρίζει πως το μεγαλύτερο μέρος των ωοθηκικών όγκων (υψηλόβαθμοι ορώδεις όγκοι) προέρχεται από υψηλόβαθμο ενδοεπιθηλιακό ορώδες καρκίνωμα στις σάλπιγγες απ’ όπου και κατευθύνεται προς τις ωοθήκες.
Η αξιολόγηση αυτών των θεωριών είναι προβληματική γιατί είναι δύσκολη η πειραματική διαδικασία. Η αξιολόγησή τους βασίζεται σε ανάλυση αυτών των μελετών υπό το πρίσμα των παρατηρήσεων στην πορεία παρακολούθησης των ωοθηκικών καρκίνων. Προσφάτως έγινε μια προσπάθεια ενσωμάτωσης των κλινικοπαθολογικών και μοριακών γενετικών στοιχείων των θεωριών αυτών έτσι ώστε να δημιουργηθεί μια ενοποιημένη θεωρία για την ωοθηκική καρκινογένεση. Πιο συγκεκριμένα:
Η θεωρία της προέλευσης από το επιφανειακό επιθήλιο της ωοθήκης (μεσοθήλιο) παρουσιάζει πολλούς περιορισμούς. Ιστολογικά, το μεσοθήλιο που καλύπτει τις ωοθήκες δεν φέρει καμία ομοιότητα με το ορώδες, ενδομητριοειδές, βλεννώδες, διαυγοκυτταρικό και Brenner καρκίνο των ωοθηκών. Για να αντιμετωπιστούν λοιπόν αυτές οι αντιφάσεις προτάθηκε πως το μεσοθήλιο που καλύπτει τις ωοθήκες εγκολεάζει το υποκείμενο στρώμα και σχηματίζει έγκλειστα τα οποία υπό την επίδραση τοπικών παραγόντων, πιθανόν στεροειδών ορμονών, υπόκεινται σε μεταπλαστικές αλλαγές που οδηγούν στη μεταμόρφωση του μεσοθηλίου σε επιθήλιο Μυλλεριανού τύπου. Αυτά τα έγκλειστα με τον καινούριο τους Μυλλεριανό φαινότυπο, μπορούν να υποστούν κακοήθη εξαλλαγή σε καρκίνο διαφόρων κυτταρικών τύπων (ορώδης, ενδομητριοειδής και διαυγοκυτταρικός).
Αν και τέτοιου είδους έγκλειστα (Μυλλεριανού τύπου επιθηλίου) παρατηρούνται συχνά στον ωοθηκικό φλοιό, δε διευκρινίζεται τί μπορεί να θεωρηθεί ως μετάβαση από αυτά. Επιπλέον, έγκλειστα επικαλυμμένα με εντερικού τύπου επιθήλιο που μεταμορφώνονται σε βλεννώδες καρκίνο, δεν ανευρίσκονται συχνά. Το ίδιο μπορεί να ειπωθεί για την απουσία μεταβατικού επιθηλίου για την ανάπτυξη όγκων Brenner.
Τα μειονεκτήματα της Μυλλεριανής θεωρίας είναι ότι οι πρόδρομες βλάβες που μοιάζουν με ορώδες, ενδομητριοειδές και διαυγοκυτταρικό καρκίνο, σπάνια έχουν διαπιστωθεί σε παρασαλπιγγικές και παραωοθηκικές κύστες. Επιπλέον, η πλειοψηφία των βλεννωδών καρκίνων παρουσιάζει εντερικού αντί για ενδοτραχηλικού τύπου βλεννώδη διαφοροποίηση και για αυτό δε χαρακτηρίζεται ως Μυλλεριανός όγκος. Παρόμοιο πρόβλημα υπάρχει και για τους όγκους Brenner που προσομοιάζουν με το ουροθήλιο, που δεν είναι Μυλλεριανής προέλευσης. Τα περισσότερα στοιχεία υποδηλώνουν ότι το μεγαλύτερο μέρος αυτών που θεωρούνται πρωτογενείς καρκίνοι ωοθήκης (ορώδης, ενδομητριοειδής, διαυγοκυτταρικός) προέρχονται από τις σάλπιγγες και το ενδομήτριο και όχι από τις ωοθήκες.
Προηγούμενες μελέτες δεν καταδεικνύουν πρόδρομες βλάβες στον καρκίνο των ωοθηκών. Μελέτες σε φυσιολογικές ωοθήκες ετερόπλευρα από ωοθήκες με καρκίνο (μη κληρονομικό), ποτέ δεν ανέδειξαν μια πειστική πρόδρομη βλάβη. Πρόσφατες, όμως, μελέτες ανέδειξαν έναν αριθμό μορφολογικών αλλαγών σε φαινομενικά φυσιολογικές ωοθήκες , όπως αυξημένο αριθμό κύστεων που εγκλείουν το υποκείμενο στρώμα καθώς και μικρού βαθμού ατυπίες.
Εξαιτίας του ότι είχε υποτεθεί πως ο προάγγελος του ωοθηκικού καρκίνου λογικά βρισκόταν στις ωοθήκες, ο ρόλος των σαλπίγγων δεν είχε αξιολογηθεί προσεκτικά. Μελέτες, όμως, που εστίασαν στις σάλπιγγες επιβεβαίωσαν πως μικρές in situ σαλπιγγικές νεοπλασίες εμφανίζονται σε γυναίκες με γενετική προδιάθεση για την ανάπτυξη ωοθηκικού καρκίνου. Αυτό οδήγησε στο να συμπεριληφθεί ο καρκίνος των σαλπίγγων στην ομάδα καρκίνων που συνδέονται με τις κληρονομικές μεταλλάξεις του BRCA. Στη συνέχεια προτάθηκε ότι ένα μέρος των ωοθηκικών όγκων μπορεί να είναι το αποτέλεσμα εμφύτευσης κακοήθων κυττάρων από τον σαλπιγγικό όγκο στις ωοθήκες. Το επόμενο βήμα συνέδεε αυτό που θεωρούνταν ως ενδοεπιθηλιακός σαλπιγγικός καρκίνος ή ως ορώδης ενδοεπιθηλιακός σαλπιγγικός καρκίνος με τον καρκίνο των ωοθηκών αφού πάνω από το 70% του μη κληρονομικού ωοθηκικού και περιτοναϊκού υψηλόβαθμου ορώδους καρκινώματος εμπλέκονταν με βλεννώδη σαλπιγγικής προέλευσης.
Αυτή η παρατήρηση έδωσε βάση στην πρόταση ότι οι ορώδεις ενδοεπιθηλιακοί σαλπιγγικοί καρκίνοι, που σχεδόν πάντα ανιχνεύονται στον κώδωνα, μπορεί να είναι η πηγή του υψηλόβαθμου ορώδους καρκινώματος στις γυναίκες με κληρονομικές μεταλλάξεις BRCA αλλά και στις γυναίκες χωρίς προδιάθεση για καρκίνο των ωοθηκών. Παρ’ όλο που δεν έχει ακόμα ξεκαθαρίσει εάν η βλεννώδης σαλπιγγική συμμετοχή μπορεί να αντιστοιχεί σε δευτερογενή εξάπλωση από έναν καρκίνο ωοθήκης στο ίδιο δείγμα, η παρουσία τοπικών μη συνεχόμενων ενδοεπιθηλιακών βλαβών (ορώδης ενδοεπιθηλιακός σαλπιγγικός καρκίνος) μπορεί να είναι μια ασυνήθιστη έκφραση μεταστάσεων. Επιπλέον, η αναγνώριση ορώδους ενδοεπιθηλιακού σαλπιγγικού καρκίνου σε δείγματα από γυναίκες με κληρονομική προδιάθεση για καρκίνο ωοθήκης, όπου ολοκληρωμένος μικροσκοπικός έλεγχος σε σάλπιγγες και ωοθήκες απέτυχε να εξακριβώσει διηθητικό καρκίνο σε αυτά τα όργανα, ενισχύει την ιδέα ότι οι ορώδεις νεοπλαστικές διεργασίες μπορεί να ξεκινούν από τις σάλπιγγες παρά από τις ωοθήκες. Περαιτέρω ενίσχυση αυτής της άποψης προκύπτει από το γεγονός ότι σχεδόν όλοι οι ορώδεις ενδοεπιθηλιακοί σαλπιγγικοί καρκίνοι υπερεκφράζουν το P53, όπως ο υψηλόβαθμος ορώδης καρκίνος
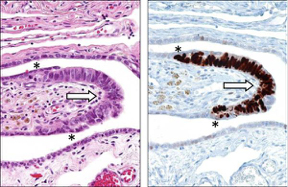
Εικόνα 1: Ορώδης σαλπιγγικός ενδοεπιθηλιακός καρκίνος (Serous Tubal Intraepithelial Carcinoma -STIC). A. Μεγάλη μεγέθυνση. Βαφή αιματοξυλίνης και ηωσίνης. B. Ανοσοϊστοχημική βαφή για p53.
Μελέτες με μικροτομές laser αυτών των βλαβών απέδειξαν ότι παρουσιάζουν μεταλλάξεις του TP53. Επιπλέον, ο ορώδης ενδοεπιθηλιακός σαλπιγγικός καρκίνος με συνυπάρχοντα καρκίνο ωοθήκης μοιράζονται όχι μόνο κοινά μορφολογικά στοιχεία αλλά και τις ίδιες μεταλλάξεις στο TP53.
Πρόσθετα αποδεικτικά στοιχεία που ενοχοποιούν τις σάλπιγγες παρά τις ωοθήκες ως την περιοχή προέλευσης του ορώδους καρκίνου προέρχονται από μια μελέτη γονιδίων που δείχνει ότι το προφίλ της έκφρασης γονιδίων υψηλόβαθμου ορώδους καρκίνου σχετίζεται πολύ περισσότερο με τις σάλπιγγες παρά με την ωοθήκης.
Εκτός αυτού, ο υψηλόβαθμος ορώδης καρκίνος εκφράζει το PAX8 (Μυλλεριανός δείκτης) και όχι καλρετινίνη (μεσοθηλιακός δείκτης). Επίσης, ανευρέθηκε ότι και το καλόηθες σαλπιγγικό επιθήλιο εκφράζει το TP53.
Βασιζόμενοι σε αυτές τις ανακαλύψεις μια αλληλουχία παθογενετικών γεγονότων προτάθηκε ξεκινώντας με τοξικές βλάβες στο DNA, εν συνεχεία μεταλλάξεις του TP53 και προοδευτική αδυναμία ελέγχου του κυτταρικού κύκλου, το οποίο έπειτα καταλήγει στην ανάπτυξη καρκίνου.
Γενικά μια νεοπλασία πριν αποκτήσει την ικανότητα μετάστασης, πρέπει πρώτα να εισχωρήσει και να βρει πρόσβαση στο φλεβικό δίκτυο ή στο λεμφικό σύστημα. Παρατηρήσαμε ότι ο κώδωνας περιέχει πλούσιο λεμφαγγειακό δίκτυο. Επιπλέον, είναι σε σχεδόν άμεση επαφή με τη βασική μεμβράνη του σαλπιγγικού επιθηλίου και για αυτό ο καρκίνος των σαλπίγγων ίσως να μη χρειάζεται μεγάλο μέγεθος για να εισβάλλει σε αυτό το εξαιρετικά προσβάσιμο λεμφαγγειακο δίκτυο. Εκτός αυτού, η διήθηση στην περίπτωση του ορώδους ενδοεπιθηλιακού σαλπιγγικού καρκίνου ίσως να μην είναι αναγκαία για εξάπλωση. Τα σαλπιγγικά ενδοεπιθηλιακά νεοπλάσματα είναι όμοια μορφολογικά και ανοσοϊστοχημικά με το ενδοεπιθηλιακό ενδομητριοειδές καρκίνωμα, το οποίο θεωρείται πρόδρομη ή πρόωρη μορφή ορώδους καρκίνου της μήτρας. Αυτές οι βλάβες έχουν επίσης αναγνωρισθεί και ως επιφανειακά ορώδη καρκινώματα της μήτρας. Διαδίδονται διαμέσω της περιτοναϊκής κοιλότητας πιθανόν λόγω της προσπέλασης καρκινικών κυττάρων διαμέσω των σαλπίγγων χωρίς διήθηση του μυομητρίου. Τα κύτταρα που αποτελούν το ενδομητριοειδές και το ενδοεπιθηλιακό καρκίνο των σαλπίγγων είναι εξαιρετικά αναπλαστικά και όμοια μορφολογικά με τον υψηλού βαθμού ορώδη.
Πιθανότατα, αυτά τα κύτταρα μπορούν να εμφυτευθούν στην επιφάνεια των ωοθηκών και του περιτοναίου, απουσία διηθητικών φαινομένων στις σάλπιγγες. Την υπόθεση την υποστηρίζουν οι θετικές κυτταρολογικές πλύσεις σε γυναίκες όπου η μόνη βλάβη ήταν ορώδης ενδοεπιθηλιακός σαλπιγγικός καρκίνος. Σε μελέτες ωοθηκικού και πρωτογενούς περιτοναϊκού υψηλόβαθμου ορώδους καρκίνου, βλεννώδης εμπλοκή των σαλπίγγων διαπιστώθηκε στο 70% των περιπτώσεων. Η ερώτηση που προκύπτει αφορά στην προέλευση του εναπομείναντος ωοθηκικού καρκίνου όπου λείπουν οι ενδείξεις συμμετοχής των σαλπίγγων. Σε αυτές τις περιπτώσεις οι υψηλού βαθμού καρκίνοι παρουσίαζαν KRAS μεταλλάξεις όμοιες μεταλλάξεις με εκείνες των ορώδων borderline καρκίνων, ενώ δεν υπήρχαν μεταλλάξεις TP53. Αυτά τα αποτελέσματα οδηγούν στο συμπέρασμα ότι ορώδεις καρκίνοι υψηλού βαθμού προέρχονται από χαμηλού βαθμού και όχι με την συνήθη αλληλουχία (Τύπου II) που ξεκινά από μεταλλάξεις του TP53. Ο κώδωνας των σαλπίγγων φυσιολογικά είναι σε άμεση επαφή με την επιφάνεια των ωοθηκών τη στιγμή της ωορρηξίας. Είναι αντιληπτό πως όταν το επιθήλιο της ωοθηκικής επιφάνειας διαρρηγνύεται την στιγμή της ωορρηξίας, φυσιολογικά κύτταρα επιθηλίου από τον κώδωνα των σαλπίγγων, μπορεί να μετακινηθούν και να εμφυτευθούν στην ωοθήκη σχηματίζοντας μια κύστη από την οποία μπορεί να αναπτυχθεί. Αυτός ο μηχανισμός θα μπορούσε να εξηγήσει και την ανάπτυξη ενδοσαλπιγγίωσης, μια βλάβη αποτελούμενη από αδένες και θηλώδεις δομές καλυμμένες από σαλπιγγικού τύπου επιθήλιο που βρίσκεται στην περιτοναϊκή επιφάνεια της πυέλου, του επίπλου και πίσω από τους πυελικούς και παρααορτικούς λεμφαδένες. Η ενδοσαλπιγγίωση συχνά συνυπάρχει με χαμηλού βαθμού ορώδη καρκίνο και έχει θεωρηθεί ως πιθανή πρόδρομη κατάσταση αυτών των καρκίνων. Πάντως, η πιθανότητα ότι ορισμένοι υψηλού βαθμού ορώδεις καρκίνοι ξεκινούν από μια μεταπλαστική διαδικασία από το ωοθηκικό επιθήλιο παρά από εμφύτευση φυσιολογικού σαλπιγγικού επιθηλίου, δεν μπορεί να απορριφθεί πλήρως. (εικόνα 2)
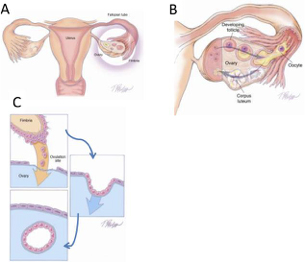
Εικόνα 2:
Μεταφορά του φυσιολογικού σαλπιγγικού επιθηλίου στην ωοθήκη.
A. Ανατομική σχέση σαλπίγγων και ωοθηκών τη στιγμή της ωορρηξίας. Οι κώδωνες τυλίγουν την ωοθήκη.
B. Ωορρηξία. Η ωοθηκική επιφάνεια διαρρηγνύεται με μεταφορά των ωοκυττάρων στους κώδωνες. Οι κώδωνες είναι σε στενή επαφή με την ωοθήκη στη θέση της ρήξης.
Γ. Σαλπιγγικά επιθηλιακά κύτταρα από τους κώδωνες έχουν αποσπασθεί και εμφυτευθεί στην απογυμνωμένη επιφάνεια της ωοθήκης το οποίο μεταφράζεται στη δημιουργία κύστεων.
Η θεωρία της απευθείας εμφύτευσης σαλπιγγικού επιθηλίου στις ωοθήκες για τον σχηματισμό κύστεων οι οποίες θα είναι η έδρα έναρξης ωοθηκικού ορώδους καρκίνου, αν και ακόμα δεν έχει αποδειχθεί, είναι μια ελκυστική εναλλακτική θεωρία από αυτήν της μετάπλασης του μεσοθηλίου. Εμφύτευση του σαλπιγγικού επιθηλίου από τον κώδωνα την στιγμή της ωορρηξίας, όταν το επιφανειακό επιθήλιο είναι διασπασμένο, μπορεί να εξηγήσει την αρχή χαμηλού και υψηλού βαθμού ορώδους καρκίνου. Στην περίπτωση χαμηλού βαθμού ορώδους καρκίνου, η διαδικασία εξελίσσεται αργά από ορώδες κυσταδένωμα και μετά σε borderline ορώδη καρκίνο έπειτα από μεταλλάξεις στα KRAS και BRAF γονίδια, ενώ στην περίπτωση υψηλού βαθμού ορώδους καρκίνου η διαδικασία εξελίσσεται γρήγορα, έπειτα από μετάλλαξη στο TP53 γονίδιο με την ανάπτυξη ενδοεπιθηλιακού καρκίνου ως ενδιάμεσο στάδιο. Σύμφωνα με αυτή την οπτική γωνία και ο χαμηλού αλλά και ο υψηλού βαθμού ορώδης καρκίνος είναι τελικά Μυλλεριανής προέλευσης και κατά έναν τρόπο η ωοθήκη εμπλέκεται δευτερογενώς. (εικόνα 3)
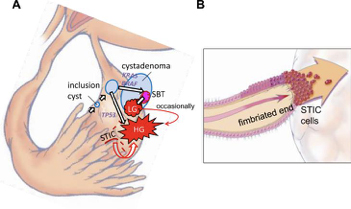
Εικόνα 3Α και 3Β: Μηχανισμοί ανάπτυξης ορώδους Ca
Προτεινόμενη ανάπτυξη για τον χαμηλού και υψηλού βαθμού ορώδη Ca.
A. Ένας μηχανισμός αφορά το φυσιολογικό σαλπιγγικό επιθήλιο το οποίο προέρχεται από τον κώδωνα, το οποίο εμφυτεύεται στην ωοθήκη σχηματίζοντας κύστεις. Εξαρτάται από το αν υπάρχει μετάλλαξη στα γονίδια KRAS/BRAF/ERBB2 ή TP53 οπότε χαμηλού βαθμού ή υψηλού βαθμού ορώδης καρκίνος αναπτύσσεται αντίστοιχα. Χαμηλού βαθμού ορώδης καρκίνος συχνά αναπτύσσεται από ορώδη Borderline Ca, το οποίο με τη σειρά του προέρχεται από ορώδες κυσταδένωμα. Ένας άλλος μηχανισμός περιλαμβάνει μετανάστευση κακοηθών κυττάρων, από ορώδη σαλπιγγικό ενδοεπιθηλιακό καρκίνο (STIC), που εμφυτεύονται στην επιφάνεια της ωοθήκης με αποτέλεσμα την ανάπτυξη υψηλού βαθμού ορώδους καρκίνου.
Β. Μια σχηματική απεικόνιση απευθείας διάδοσης ή μεταφοράς κυττάρων ορώδους σαλπιγγικού ενδοεπιθηλιακού καρκίνου στην ωοθηκική επιφάνεια όπου τα καρκινικά κύτταρα τελικά δημιουργούν έναν όγκο ο οποίος φαίνεται να προέρχεται από την ωοθήκη. Υπάρχουν στάδια στην ανάπτυξη του καρκίνου που προηγούνται τον σχηματισμό ορώδους σαλπιγγικού ενδοεπιθηλιακού καρκίνο.
Έχει εξακριβωθεί πλήρως και από μορφολογικές αλλά πρόσφατα και από μοριακές γενετικές μελέτες ότι ο χαμηλού βαθμού ενδομητριοειδής και ο διαυγοκυτταρικός καρκίνος αναπτύσσεται από ενδομητριωσικές κύστεις (ενδομητρίωμα), που συχνά συνδυάζονται με εστίες ενδομητρίωσης σε άλλα μέρη της πυέλου. Παρ’ όλο που η ακριβής θέση της ενδομητρίωσης δεν έχει εξακριβωθεί πλήρως, είτε αναπτύσσεται in situ στο περιτόναιο διαμέσω μιας διαδικασίας μετάπλασης είτε από μια παλίνδρομή έμμηνο ρύση. Έτσι, αν η παλίνδρομος έμμηνος ρύση συναντάται στις περισσότερες περιπτώσεις ενδομητρίωσης, είναι λογικό να υποθέσουμε ότι ο ενδομητριοειδής και διαυγοκυτταρικός καρκίνος αναπτύσσεται από ενδομητρικό ιστό (Μυλλεριανής προέλευσης) που εμφυτεύεται στην ωοθήκη και έτσι η ωοθήκη εμπλέκεται δευτερογενώς. Περαιτέρω ενδιαφέρον υπήρξε στην παρατήρηση ότι το έκτοπο ενδομήτριο σε γυναίκες με ενδομητρίωση εκφράζει μοριακές ανωμαλίες, όπως ενεργοποίηση ογκογενών μονοπατιών. Πιθανώς, αυτές οι αλλαγές επιτρέπουν στον ενδομητρικό ιστό να εμφυτευθεί, να επιβιώσει και να διεισδύσει στην ωοθηκική και περιτοναϊκή επιφάνεια. Αυτή η υπόθεση από την οποία ο ενδομητριοειδής και διαυγοκυτταρικός καρκίνος αναπτύσσονται από ενδομητρικό ιστό εμφυτευμένο στις ωοθήκες υποστηρίζεται και από επιδημιολογικές αποδείξεις που έδειξαν την προστατευτική δράση της περίδεσης των σαλπίγγων έναντι μόνο των ενδομητριοειδών και διαυγοκυτταρικών καρκίνων της ωοθήκης (εικόνα 4)
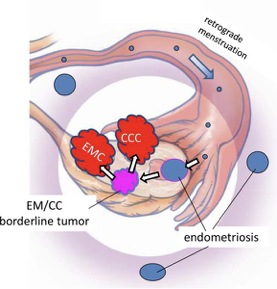
Εικόνα 4:
Προτεινόμενη ανάπτυξη για τον χαμηλού βαθμού ενδομητριοειδή και διαυγοκυτταρικό καρκίνο. Ενδομητρικός ιστός, μέσω ενός μηχανισμού παλίνδρομης εμμήνου ρύσεως, εμφυτεύεται στην ωοθηκική επιφάνεια για τον σχηματισμό ενδομητριωσικής κύστης απο την οποία μπορεί να αναπτυχθεί χαμηλού βαθμού ενδομητριοειδής ή διαυγοκυτταρικός καρκίνος.
EMC: χαμηλού βαθμού ενδομητριοειδής καρκίνος ωοθήκης; CCC: διαυγοκυτταρικός καρκίνος ωοθήκης.
Ομοίως, η προέλευση του βλεννώδους καρκίνου γαστρεντερικού τύπου και του τύπου Brenner μπορεί επίσης να μην εμπλέκει πρωτογενώς τις ωοθήκες. Η προέλευση αυτών των τύπων διερευνάται αφού σε αντίθεση από τον ορώδη, ενδομητριοειδή και διαυγοκυτταρικό τύπο, δεν παρουσιάζει Μυλλεριανό φαινότυπο. Ενώ είχε συζητηθεί πως ο βλεννώδης τύπος φέρει μια σχέση με τον ενδοτράχηλο, το βλεννώδες επιθήλιο που χαρακτηρίζει αυτές τις νεοπλασίες έχει πιο στενές ομοιότητες με τον γαστρεντερικό βλεννογόνο. Επιπλέον, η συνύπαρξη όγκων Brenner και βλεννώδους τύπου είναι γνωστή από χρόνια. Σε μια μελέτη βλεννωδών κυστοαδενωμάτων και Brenner όγκων, αναφέρθηκε ότι τα βλεννώδη κυστοαδενώματα περιείχαν εστίες Brenner στο 18% των περιπτώσεων. Επίσης ο βλεννώδης καρκίνος συχνά συνδυάζεται με καλοήθες μεταβατικού τύπου επιθήλιο, συχνά ευρισκόμενα σε παραωοθηκική και παρασαλπιγγική θέση. Αυτά τα ευρήματα εγείρουν την υποψία πως ο βλεννώδης καρκίνος και ο Brenner έχουν την ίδια προέλευση. Η μελέτη έδειξε ότι οι όγκοι Brenner είναι μικροί (μέσο μέγεθος 0,5cm, εύρος 0,02-20cm) ενώ τα βλεννώδη κυστοαδενώματα είναι μεγαλύτερα ( μέσο μέγεθος 9cm, εύρος 1-30cm). Ενώ ένας μικρός όγκος Brenner αναπτύσσεται, το βλεννώδες μέρος γίνεται κυρίαρχο δίνοντας ένα βλεννώδες κυσταδένωμα, το οποίο ενώ μεγαλώνει συμπιέζει και εντέλει εξαλείφει την διπλανή ωοθήκη δίνοντας την εντύπωση πως προέρχεται από την ωοθήκη.
Ανακεφαλαιώνοντας καμία από τις υπάρχουσες θεωρίες δεν συνδυάζει επαρκώς όλα τα στοιχεία της ωοθηκικής καρκινογένεσης. Κάθε μια από αυτές έχει κάτι να προσφέρει στην εξήγηση για την ανάπτυξη του ωοθηκικού καρκίνου αλλά καμία δεν τα περιέχει όλα. Έχει διαπιστωθεί ότι αυτό που θεωρούνταν πρωτογενής επιθηλιακός ωοθηκικός και πρωτογενής περιτοναϊκός καρκίνος είναι εντέλει δευτερογενής. Τα πιο πειστικά στοιχεία που στηρίζουν την άποψη ότι ο ορώδης καρκίνος αναπτύσσεται από το κωδωνικό άκρο των σαλπίγγων, ο ενδομητριοειδής και ο διαυγοκυτταρικός καρκίνος από ενδομητρικό ιστό που διαμέσου των σαλπίγγων καταλήγει σε ενδομητρίωση ενώ ο βλεννώδης καθώς και ο Brenner καρκίνος από μεταβατικού τύπου επιθήλιο ευρισκόμενο στο σαλπιγγομεσοθηλιακό σύνδεσμο όπου οι κώδωνες έρχονται σε επαφή με το περιτόναιο. Η άποψη ότι το μεγαλύτερο μέρος των επιθηλιακών ωοθηκικών καρκίνων προέρχεται έξω από τις ωοθήκες και τις εμπλέκει δευτερογενώς προέκυψε πρόσφατα γιατί στο παρελθόν επικρατούσε η λανθασμένη άποψη ότι προερχόταν από την ωοθήκη. Ένας καρκίνος θεωρούνταν σαλπιγγικός ως προς την προέλευση μόνο όταν το κύριο μέρος του όγκου αφορούσε την σάλπιγγα παρά την ωοθήκη και υπήρχαν ενδείξεις ενδοεπιθηλιακού in situ σαλπιγγικού καρκίνου. Η διάγνωση περιτοναϊκού πρωτοπαθούς καρκίνου είναι ακόμα πιο περιορισμένη. Ακόμα και με εκτεταμένο όγκο που αφορά στο περιτόναιο, το επίπλουν και άλλα κοιλιακά όργανα, ένας όγκος θεωρείται πρωτογενής ωοθηκικός εάν υπάρχουν τουλάχιστον 5mm καρκίνου που εμπλέκουν την ωοθήκη.
Εφαρμογές για έρευνα, screening, πρόληψη και θεραπεία
Οι εφαρμογές αυτών των νέων θεωριών για την ωοθηκική καρκινογένεση είναι πολύ σημαντικές. Η ενοχοποίηση των σαλπίγγων όσον αφορά την προέλευση του ωοθηκικού ορώδους καρκίνου εξηγεί πολλές από τις προηγούμενες αναφορές που έδειχναν «υπερέκφραση» γονιδίων συνδυαζόμενα με ωοθηκικό καρκίνο. Το προφίλ της έκφρασης των γονιδίων στο ωοθηκικό επιφανειακό επιθήλιο, το οποίο είναι μεσοθηλιακής προέλευσης, είναι διαφορετικό από το σαλπιγγικό επιθήλιο το οποίο είναι Μυλλεριανής προέλευσης. Πράγματι, τα γονίδια που εκφράζονται στον ορώδη καρκίνο είναι παρόμοια με αυτά που βρίσκονται στην περίπτωση των σαλπίγγων, ενώ το προφίλ έκφρασης του ενδομητριοειδούς και του διαυγοκυτταρικού καρκίνου προσομοιάζει στο ενδομητρικό επιθήλιο. Είναι ενδιαφέρον, επίσης, πως το προφίλ έκφρασης του βλεννώδους καρκίνου προσομοιάζει το φυσιολογικό επιθήλιο του παχέως εντέρου. Επίσης, το RAX8 είναι ένας δείκτης Μυλλεριανού τύπου επιθηλίου που εκφράζεται στον ωοθηκικό ορώδη καρκίνο, αλλά όχι στο μεσοθήλιο ενώ η καλρετινίνη, ένας δείκτης μεσοθηλίου, που σχετίζεται με το ωοθηκικό επιφανειακό επιθήλιο και το μεσοθηλίωμα αλλά όχι με το σαλπιγγικό επιθήλιο ή τον ωοθηκικό ορώδη καρκίνο. Στο μέλλον, η ανάλυση των γονιδίων με αυξημένη έκφραση στον ωοθηκικό καρκίνο πρέπει να λαμβάνει υπόψη τον ιστολογικό τύπο των εκάστοτε καρκίνων. (εικόνα 5)
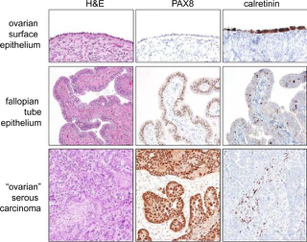
Εικόνα 5
Σύγκριση της ανοσοϊστοχημικής βαφής του επιθηλίου της ωοθηκικής επιφάνειας (μεσοθήλιο), φυσιολογικού σαλπιγγικού επιθηλίου και υψηλού βαθμού ορώδους καρκίνου. Το PAX8 είναι ένας δείκτης μυλλέριαν επιθηλίου όπως είναι το σαλπιγγικό επιθήλιο και η καλρετινίνη είναι δείκτης μεσοθηλίου.
Τις τελευταίες δύο δεκαετίες πολλές μελέτες πραγματοποιήθηκαν με σκοπό την ανάπτυξη screening tests για τον καρκίνο ωοθήκης. Με σκοπό να ανακαλύπτουν εγκαίρως καρκίνους όταν είναι ακόμα εντοπισμένοι στην ωοθήκη, βελτιώνοντας έτσι τα ποσοστά της θεραπείας και μειώνοντας την θνησιμότητα. Οι σημερινές δυνατότητες για screening των γυναικών συμπεριλαμβάνουν τη γυναικολογική εξέταση, το διακολπικό υπερηχογράφημα και τη μέτρηση στον ορό του CA125. Η επίγνωση του δυαδικού μοντέλου, το οποίο τονίζει την ανομοιογένεια του ωοθηκικού καρκίνου, δείχνει ξεκάθαρα πως ένα screening test δεν θα είναι ικανοποιητικό για όλους τους τύπους ωοθηκικού καρκίνου. Οι νεοπλασίες Τύπου I (χαμηλού βαθμού ορώδες, ενδομητριοειδές, διαυγοκυτταρικό και βλεννώδες) αναπτύσσονται και φθάνουν σε μεγάλο μέγεθος όταν είναι ακόμα στα όρια της ωοθήκης. Ανευρίσκονται εύκολα με την πυελική εξέταση και/ή το διακολπικό υπέρηχογράφημα. Αποτελούν, όμως, μόνο το 25% των περιπτώσεων και είναι υπεύθυνοι για το 10% των θανάτων από ωοθηκικό καρκίνο. Για αυτό θα μπορούσε να ειπωθεί πως η ανάπτυξη μιας μεθόδου screening δεν είναι επείγουσα ανάγκη για τους Τύπου I καρκίνους. Από την άλλη μεριά, η ανακάλυψη ότι το μεγαλύτερο μέρος των καρκίνων Τύπου II (υψηλόβαθμος ορώδης και αδιαφοροποίητος καθώς και καρκινοσάρκωμα) προέρχονται έξω από την ωοθήκη υπογραμμίζει την ανάγκη για μια προσέγγιση screening για την εντόπιση αυτών των καρκίνων όταν περιορίζονται ακόμα στην ωοθήκη. Επιπλέον, οι Τύπου II αποτελούν το 75% των περιπτώσεων και είναι υπεύθυνοι για το 90% των θανάτων από ωοθηκικό καρκίνο. Δυστυχώς, οι Τύπου II σπάνια περιορίζονται μόνο στην ωοθήκη. Από μια μελέτη 400 ασθενών από το νοσοκομείο της Ουάσινγκτον, λιγότερο από το 1,25% των υψηλόβαθμων ορώδων μορφών περιοριζόταν στην ωοθήκη. Η ματαιότητα της έγκαιρης ανίχνευσης πρόωρων μορφών καρκίνου της ωοθήκης τονίσθηκε σε μια πολυκεντρική προοπτική μελέτη στην οποία παρά τον ετήσιο έλεγχο screening περίπου 35.000 γυναικών με CA 125 και διακολπικό υπερηχογράφημα, το 70% των γυναικών ανιχνεύτηκαν σε προχωρημένο στάδιο της νόσου. Τα αποτελέσματα αυτά δεν είχαν καμία διάφορα από τον γενικό πληθυσμό. Για τους καρκίνους Τύπου II, ο σκοπός του screening θα έπρεπε να είναι η ανίχνευση μικρών όγκων και όχι χαμηλού σταδίου. Αυτό μπορεί να επιτευχθεί μόνο μέσω ειδικών βιοδεικτών που εκφράζονται νωρίς στην ωοθηκική καρκινογένεση.
Όπως και με το screening test, η θεραπεία για τους καρκίνους Τύπου I και Τύπου II πρέπει να εξατομικευθεί. Οι Τύπου I είναι γενικά χαμηλού βαθμού, αναπτύσσονται αργά και είναι στα όρια των ωοθηκών τη στιγμή της διάγνωσης ενώ εξαπλώνονται αργά. Έτσι, όταν ευρίσκονται ακόμα στα όρια της ωοθήκης μια σαλπιγγοωοθηκεκτομή μπορεί να αρκεί. Από την άλλα μεριά, όταν έχουν εξαπλωθεί εκτός ωοθήκης, οι χημειοθεραπευτικοί παράγοντες που είναι δραστικοί εναντίον στους πιο ταχύτερα αναπτυσσόμενους καρκίνους Τύπου II, δεν είναι δραστικοί για τους Τύπου I διότι έχουν πιο αργή ανάπτυξη. Για αυτό τον λόγο, χρειάζεται μια νέα θεραπευτική προσέγγιση για προχωρημένα στάδια της ομάδας Τύπου I.
Η προσέγγιση για τη θεραπεία των καρκίνων Τύπου II, πρέπει να είναι εντελώς διαφορετική από αυτή των Τύπου I. Πρέπει να βασίζεται στην ανίχνευση ειδικών βιοδεικτών, πριν η νόσος γίνει εμφανής. Ένα άλλο σημαντικό θέμα όσον αφορά στη θεραπεία που πρέπει να ληφθεί υπόψιν είναι εάν οι ασθενείς που βρίσκονται να έχουν ορώδη ενδοεπιθηλιακό σαλπιγγικό καρκίνο πρέπει να υποβληθούν σε χημειοθεραπεία. Τα ευρήματα θετικών κυτταρολογικών πλύσεων σε ασθενείς με μόνο ορώδη ενδοεπιθηλιακό σαλπιγγικό καρκίνο δείχνουν ότι αυτές οι μικροσκοπικές βλάβες μπορεί να κρύβουν κακοήθη κύτταρα. Προς το παρόν δεν υπάρχου οδηγίες για το αν αυτές οι γυναίκες πρέπει να θεραπεύονται.
Τέλος, οι πολλές ενδείξεις ότι ο καρκίνος ωοθήκης δεν προέρχεται από τις ωοθήκες καθώς και η αποτυχία για ένα αξιόπιστο screening test, επιβάλλουν εντατικοποίηση των προσπαθειών για πρωτογενή πρόληψη. Έχει ήδη αποδειχθεί σε επιδημιολογικές μελέτες πως η χρήση αντισυλληπτικών δισκίων μειώνει τον κίνδυνο καρκίνου ωοθήκης. Ο κίνδυνος μειώνεται κατά 50% σε γυναίκες που κάνουν χρήση αντισυλληπτικών δισκίων για 5 η περισσότερα χρόνια. Η εγκυμοσύνη μειώνει επίσης τον κίνδυνο κατά 50% σε σχέση με γυναίκες που δεν είχαν εγκυμοσύνες. Η κλασσική προσέγγιση για τη μείωση του κινδύνου σε γυναίκες με οικογενειακό ιστορικό καρκίνου ωοθήκης ή σε γυναίκες με μεταλλάξεις σε BRCA1/2 ήταν η ολική υστερεκτομία μετά των εξαρτημάτων. Οι ωοθηκικοί καρκίνοι που αναπτύσσονται είναι σχεδόν πάντα υψηλού βαθμού ορώδεις και δεν υπήρξαν ικανοποιητικές αποδείξεις ότι αυτές οι γυναίκες είναι σε υψηλό κίνδυνο για την ανάπτυξη ορώδους καρκίνου μήτρας. Εάν μπορέσει να αποδειχθεί ότι ο ορώδης καρκίνος σε αυτές τις γυναίκες προέρχεται σχεδόν αποκλειστικά από τον κώδωνα τότε η σαλπιγγεκτομή από μόνη της θα είναι ικανή να μειώσει τον κίνδυνο καρκίνου ωοθήκης. Αυτή η προσέγγιση θα πρέπει να αξιολογηθεί σε τυχαιοποιημένες κλινικές μελέτες συγκρίνοντας τα αποτελέσματα με την κλασσική αμφοτερόπλευρη σαλπιγγοωθηκεκτομή. Επίσης για γυναίκες οι οποίες δεν θεωρούνται υψηλού κινδύνου αλλά που υποβάλλονται σε υστερεκτομία για καλοήθεις παθήσεις, πολλοί γυναικολόγοι πιστεύουν ότι πρέπει να εφαρμόζεται και αμφοτερόπλευρη αφαίρεση των ωοθηκών για να μειωθεί ο κίνδυνος ανάπτυξης καρκίνου. Όμως αποδείχθηκε ότι σε σύγκριση με την διατήρηση των ωοθηκών, η ολική υστερεκτομία μετά των εξαρτημάτων συνδυάστηκε με αυξημένο κίνδυνο όλων των αιτιών θανάτου, θανατηφόρα ή μη στεφανιαία νόσος και καρκίνος πνεύμονα. Για αυτό σε γυναίκες που υποβάλλονται σε υστερεκτομία για καλοήθεις παθήσεις, η αφαίρεση μόνο των σαλπίγγων με διατήρηση των ωοθηκών θα βελτίωνε την ποιότητα ζωής και την επιβίωση ενώ θα μείωνε και τον κίνδυνο καρκίνου ωοθήκης.
Συμπεράσματα
Η καινούρια προσέγγιση για την παθογένεση του ωοθηκικού καρκίνου βασίζεται σε ένα δυαδικό μοντέλο. Το μεγαλύτερο μέρος των ωοθηκικών καρκίνων προέρχεται έξω από τις ωοθήκες γεγονός που διευκολύνει την ανάπτυξη νέων προσεγγίσεων για πρόληψη, screening και θεραπεία. Η ομάδα Τύπου I παρουσιάζεται χωρίς άλγος, συνήθως σε στάδιο Ι και αναπτύσσεται από πρόδρομες βλάβες, τους λεγόμενους χαμηλής δυνητικής κακοήθειας όγκους. Αυτοί οι όγκοι χαρακτηρίζονται από μεταλλάξεις των γονιδίων KRAS, BRAF, ERBB2, CTNNB1, PTEN και PIK3CA αλλά σπάνια μεταλλάξεις των γονιδίων TP53. Παρουσιάζουν μια γενική σταθερότητα γενετικά. Η άλλη ομάδα, οι καρκίνοι Τύπου II, αποτελείται από επιθετικούς καρκίνους, παρουσιαζόμενοι σε προχωρημένα στάδια και αναπτύσσονται από ενδοεπιθηλιακό καρκίνο των σαλπίγγων. Παρουσιάζουν υψηλά ποσοστά μεταλλάξεων του γονιδίου TP53, αλλά σπάνια των μεταλλάξεων των γονιδίων της ομάδας Τύπου I . Γενετικώς είναι πολύ ασταθείς.
Αυτό το προτεινόμενο μοντέλο δεν είναι ολοκληρωμένο και δεν καλύπτει όλα τα θέματα. Για παράδειγμα, Ο διαυγοκυτταρικός καρκίνος κατηγοριοποιείται ως Τύπου I γιατί παρουσιάζει μια χαρακτηριστική μετάλλαξη του γονιδίου PIKC3CA, γενετικά σταθερή, συχνά παρουσιάζεται σε στάδιο Ι και συνδυάζεται με ενδομητρίωση, μια καλά αναγνωρισμένη πρόδρομη βλάβη. Όμως, αντίθετα, με τους άλλους καρκίνους της ομάδας Τύπου I, ο διαυγοκυτταρικός είναι υψηλού βαθμού κατά τη διάγνωση.
Πρόσφατες μελέτες για την προέλευση του ωοθηκικού καρκίνου προσανατολίστηκαν προς μια υποθετική πρόδρομη βλάβη στις σάλπιγγες που μορφολογικά και μοριακά μοιάζει με υψηλού βαθμού ορώδη καρκίνο. Αυτή η βλάβη ονομάστηκε ορώδης ενδοεπιθηλιακός σαλπιγγικός καρκίνος. Έτσι, αντί να αναπτύσσεται de novo από τις ωοθήκες, όπως θεωρούνταν, το μεγαλύτερο μέρος των καρκίνων Τύπου II φαίνεται να προέρχεται από ορώδη ενδοεπιθηλιακό σαλπιγγικό καρκίνο στο κωδωνικό άκρο των σαλπίγγων που επεκτείνονται στις ωοθήκες.
Ένας άλλος πιθανός μηχανισμός για την ανάπτυξη ωοθηκικού καρκίνου είναι η μετατόπιση φυσιολογικού σαλπιγγικού επιθηλίου διαμέσω του κώδωνα, το οποίο εμφυτεύεται στη θέση ρήξης όταν γίνεται η ωορρηξία, με αποτέλεσμα τον σχηματισμό κύστεων που μπορεί να υποστούν κακοήθη εξαλλαγή. Έτσι, ο ορώδης καρκίνος μπορεί να αναπτυχθεί από κύστεις αλλά από μια διαδικασία εμφύτευσης σαλπιγγικού (Μυλλεριανού τύπου) ιστού παρά από μια διαδικασία μετάπλασης από ωοθηκικό επιφανειακό επιθήλιο (μεσοθήλιακού τύπου). Το ενδομητριοειδές και το διαυγοκυτταρικό καρκίνωμα μπορεί επίσης να προέρχονται από μη ωοθηκικό, Μυλλεριανού τύπου ιστό μιας και είναι ευρέως αποδεκτό ότι αυτοί οι καρκίνοι αναπτύσσονται από ενδομητρίωση, η οποία πιστεύεται ότι προέρχεται από παλίνδρομη έμμηνο ρύση. Η προέλευση του βλεννώδους και του Brenner καρκίνου δεν είναι ακόμα ξεκάθαρη, παρ’ όλα αυτά πρόσφατα στοιχεία προτείνουν μια πιθανή προέλευση από μεταβατικού τύπου εστίες παρασαλπιγγικά ή παραωοθηκικά. Η εξωωοθηκική προέλευση του καρκίνου των ωοθηκών εξηγεί γιατί οι σημερινές στρατηγικές screening που σχεδιάζονται για να εντοπίζουν τον ωοθηκικό καρκίνο, όταν είναι στα όρια της ωοθήκης, είναι αναποτελεσματικές.
Δεδομένων των δυσκολιών για την πρόωρη διάγνωση και την σχετικά μικρή επιτυχία στη θεραπεία, οι προσπάθειες θα έπρεπε να προσανατολιστούν προς την πρωτογενή πρόληψη. Αυτό αποκτά μεγάλη σημασία αν αναλογιστούμε πως το μεγαλύτερο μέρος των ωοθηκικών καρκίνων προέρχεται από κύτταρα στις σάλπιγγες η από πέρασμα ενδομητρικού ιστού διαμέσου των σαλπίγγων και τον σημαντικό ρόλο της ωορρηξίας στην ωοθηκική καρκινογένεση. Η σαλπιγγεκτομή από μόνη της μπορεί να αρκεί , καθώς η αφαίρεση των σαλπίγγων μειώνει τον κίνδυνο ωοθηκικού καρκίνου ενώ διατηρεί την ωοθηκική λειτουργία. Η διατήρηση των ωοθηκών φαίνεται υψίστης σημασίας για την υγεία των γυναικών, καθώς απεδείχθη πως η αφαίρεση των ωοθηκών συνδυάζεται με αυξημένοι θνησιμότητα και με υψηλή συχνότητα μη θανατηφόρων στεφανιαίων νόσων. Καινούριες εναλλακτικές θα πρέπει να αξιολογηθούν, όπως η χρήση αντισυλληπτικών δισκίων, που πιθανόν εμποδίζοντας την ωορρηξία, μειώνουν τον κίνδυνο ωοθηκικού καρκίνου κατά 50%.
Η παθογένεση του καρκίνου των ωοθηκών παραμένει μέχρι και σήμερα άγνωστη. Κατά συνέπεια η προσπάθεια που καταβάλλεται να ενοποιηθούν τα ποικίλα ερευνητικά δεδομένα στα πλαίσια μίας ενιαίας θεωρίας αποτελεί μία ακόμη υπόθεση ως προς την παθογένεια του καρκίνου των ωοθηκών.















